LE PUEDE INTERESAR
El cambio más drástico en la norma que derogó la anterior es que los laboratorios y médicos que participen en el ensayo deben estar acreditados por el departamento de Control y Regulación del Ministerio de Salud, que además acompaña en todo el proceso del estudio, informó el viceministro de Regulación, Vigilancia y Control de la Salud, Frank Pérez.
“Estas normativas favorecen el control en el manejo de los procedimientos para que no hagan pruebas que no beneficien al paciente”, explicó el viceministro.
Según el funcionario, a diferencia de las normativas anteriores, la más reciente publicación hace más claros los métodos de protección a los sujetos de ensayos clínicos, entre ellos la firma de un seguro y garantía de indemnización.
Con la nueva norma se autoriza comenzar con una investigación clínica cuando esta haya sido autorizada por el Departamento de Regulación y Control de Productos Farmacéuticos y Afines y el proyecto final de la investigación debe ser revisado y aprobado por un Comité de Ética en Investigación.
Lea también: Farmacéutica enfrenta demanda en EE. UU. por experimentos médicos con guatemaltecos
El artículo 5 de la nueva norma establece que “(…) los derechos, la seguridad, la dignidad y el bienestar de los sujetos prevalecen sobre cualquier otro interés”. Además, indica que se deben respetar los derechos del sujeto a su integridad física y mental, y a su intimidad.
En el artículo 6 también se norma que el ensayo clínico debe estar diseñado para reducir al máximo posible el dolor, la incomodidad, el miedo o cualquier otro riesgo previsible en relación con la enfermedad, edad o grado de desarrollo del sujeto.
También se amplían los requisitos para poder hacer ensayos clínicos en poblaciones vulnerables, es decir en personas con características demográficas, fisiológicas, sociales, ocupacionales o económicas susceptibles de sufrir daño o son incapaces de proteger sus propios intereses y autonomía. Entre ellos se menciona a niños, ancianos, analfabetas, enfermos mentales, privados de libertad, soldados, empleados, pacientes terminales y mujeres en edad fértil.
La indemnización se fija en la normativa en caso de un ensayo clínico con productos en fase de investigación clínica, o para nuevas indicaciones de medicamentos ya autorizados o cuando no exista interés terapéutico para la persona.
Lea también: Crear virus letales, una posibilidad que vuelve a ser legal
Además, de la acreditación y la aclaración de los métodos de protección para los pacientes, la cartera da garantía de que se verifica que los productos que se utilicen no afecten la salud de los sujetos de ensayo.
La necesidad de regular estas investigaciones es porque en las prácticas anteriores, según Pérez, las farmacéuticas contactaban a un médico, quién decidía por su cuenta a qué paciente entregar el medicamento de prueba y a quién el placebo, lo que podía traer consecuencias fatales.

Pocos ensayos en el país
El viceministro aseguró que en el país no son constantes los ensayos clínicos y que los interesados en hacerlos son las empresas farmacéuticas, entidades específicas y empresas que invierten en investigación.
“En Guatemala la investigación es limitada”, afirma Pérez.
Lo mismo confirma Enrique Aguilar, de la Gremial de Fabricantes de Productos Farmacéuticos, quien señala que solo es la industria extranjera la que realiza ese tipo de estudios, no la nacional y que generalmente se hace para medicamentos nuevos, por lo que no es recurrente.
Falta de socialización
Cesar Conde, vicepresidente del Colegio de Farmacéuticos y Químicos de Guatemala, afirmó que hace falta la socialización de estas normativas pues no se tenía conocimiento sobre las reformas a esta.
Además, el químico biólogo dijo que esta es una constante pues muchas veces el ministerio promulga acuerdos sin previa socialización, con lo que es más probable que se incumpla con la norma vigente por desconocimiento.
Además, según Conde, esa falta de socialización también provoca que la población no esté bien informada. Un ejemplo de ello es el acuerdo que prohíbe la venta de antibióticos sin receta médica.
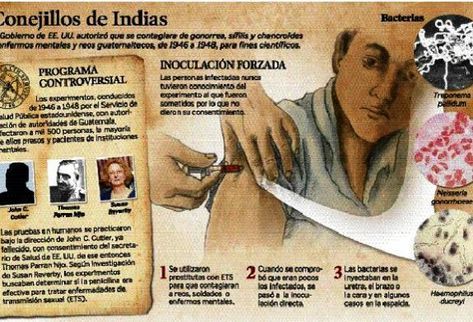
Experimento con guatemaltecos
Durante la década de los años 1940, científicos de EE. UU. infectaron a mil 500 guatemaltecos con sífilis, gonorrea y chancroide para comprobar la eficacia de la penicilina.
Lea también: Experimentos médicos de EE. UU. mataron a 83 guatemaltecos
La información sobre esas inoculaciones se hizo pública en el 2010, cuando se detalló que de 1946 a 1948 se infectó a soldados, trabajadoras sexuales, personas con enfermedades mentales y privados de libertad, quienes fueron utilizados como “conejillos de indias” durante una investigación dirigida por el doctor John Cutler.
Los procedimientos que se utilizaron en esa época no fueron éticos ya que las víctimas no estaban informadas sobre lo que ocurría.
Cutler trabajaba en la Oficina Sanitaria Panamericana, precursora de la Organización Panamericana de la Salud (OPS).
Respetar los derechos
El procurador de los Derechos Humanos, Jordán Rodas, asegura que las reformas a la norma que regula los ensayos médicos en humanos son buenas pues se incorpora a la regulación nacional estándares internacionales reconocidos por la OPS lo que dignifica a los seres humanos que colaboran.
Lea también: ¿Sabía que los humanos no estamos programados para ser felices?
Entre los beneficios, Rodas destaca que se genera conocimiento para la población, pero también hay medios que sirven para proteger y promover la salud de las personas.
Sobre las investigaciones en el país, el procurador considera que es importante que se fortalezca a la Secretaría Nacional de Ciencia y Tecnología para que tenga capacidad de desarrollar proyectos de investigación, así como la promoción de intercambios para contribuir al desarrollo de talento humano y desarrollar conocimiento en el país.
Rodas destaca experiencias exitosas de investigación en la Universidad de San Carlos, a través de la Facultad de Ciencias Médicas, y en la Universidad del Valle de Guatemala que tiene una normativa y un Comité de Ética en Investigación.
“Sin duda, impulsar la investigación requiere voluntad e interés de los centros de investigación, pero también es importante la participación de otros sectores, con estos se pueden buscar soluciones a problemas que afectan el desarrollo y dignidad de nuestra sociedad, como la desnutrición crónica y la desnutrición aguda”, estima el procurador.
Contenido relacionado
Promueven las investigaciones médicas en Quetzaltenango
Autoridades de Salud conocían experimentos hechos por EE. UU.
Comenzamos a envejecer a partir de los 25 años señala investigación